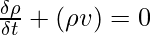Закон сохранения массы
Закон сохранения массы гласит, что масса не может быть ни создана, ни уничтожена в результате химической реакции. Это означает, что в замкнутой системе масса элементов, первоначально участвующих в химической реакции, равна массе продукта, полученного в результате реакции. Следовательно, для любого типа химической реакции общая масса реагентов и участвующих продуктов сохраняется. Эта концепция сохранения массы широко используется не только в химии, но и в других областях, таких как механика, динамика и т. д. Давайте узнаем больше о законе сохранения массы, разобравшись с его определением, формулой, примерами и решенными примерами, а также часто задаваемыми вопросами!
Что такое Закон сохранения массы?
According to the law of conservation of mass, mass is neither created nor destroyed during a chemical reaction. For example, when coal is burned, the carbon atom in it changes into carbon dioxide. The carbon atom changes from a solid to a gas, yet its mass remains constant.
Точно так же, согласно закону сохранения энергии, энергия не может быть создана или уничтожена. Например, кинетическая энергия преобразуется в потенциальную, когда игрушечный автомобиль скатывается по пандусу и сталкивается со стеной.
Система, изолированная от своего окружения, не взаимодействует с ним. В результате, какие бы изменения или химические реакции не происходили в этой изолированной системе, масса останется постоянной; даже если конечное состояние может отличаться от начального состояния, массы не может быть больше или меньше, чем до изменения или реакции.
Понимание того, что вещества в результате реакции на самом деле не исчезают, вопреки тому, что может показаться, а превращаются в другой материал с такой же массой, стало возможным благодаря закону сохранения массы, который был необходим для развитие хим.
Формула закона сохранения массы
Проще говоря, закон сохранения массы можно сформулировать так:
Mass of Reactants = Mass of Products
Однако в механике жидкости и механике сплошной среды закон сохранения массы можно представить следующим образом, используя дифференциальную форму уравнения неразрывности:
where,
- ρ is the density,
- t is the time,
- v is the velocity, and
- ∇ is the divergence.
Примеры для закона сохранения массы
Формирование воды
Вода образуется в результате соединения водорода и кислорода. Молекула воды образуется, когда водород и кислород соединяются в соотношении 2:1, образуя два моля молекулы. То есть одна молекула воды с химической формулой H 2 O имеет молекулярную массу 10. Она образована элементами водорода с молекулярной массой 2 вместе с кислородом с молекулярной массой, эквивалентной 8. Следовательно, масса сохраняется.
Образование углекислого газа
Здесь мы использовали 12 г углерода и 32 г кислорода в качестве химических соединений. После проведения реакции количество диоксида углерода, полученного в качестве продукта, составит 44 г, что эквивалентно сумме использованных количеств углерода и кислорода.
Лед и вода
Поместите небольшое количество льда — это просто замороженная вода — в коническую колбу. Теперь колбу осторожно нагревают, чтобы лед растворился в воде после надлежащего взвешивания и переполнения.
Когда колбу взвешивают еще раз, становится ясно, что вес не изменился, потому что масса льда не изменилась в результате физического преобразования.
Реакция HCl с NaOH
При соединении соляной кислоты с гидроксидом натрия в соотношении 1:1 образуется один моль хлорида натрия и один моль воды.
Ограничение закона сохранения массы
Ядерная реакция вызывает дисбаланс между массой реагентов и массой продуктов, потому что часть массы превращается в энергию.
Таким образом, общая масса не сохраняется.
Числа по закону сохранения массы
Пример 1: Если при нагревании 10,0 г карбоната кальция (CaCO 3 ) образуется 4,4 г двуокиси углерода (CO 2 ) и 5,6 г оксида кальция (CaO), покажите, что эти наблюдения согласуются с законом сохранения массы.
Отвечать:
As we know that
Mass of the reactants = Mass of the products
10.0g of CaCO3 = 4.4g of CO2+5.6g of CaO
10.0g of reactant = 10.0g of products
Because the mass of the reactant is equal to the mass of the products, the observations are in agreement with the law of conservation of mass.
Пример 2. Гидроксид калия (KOH) легко реагирует с диоксидом углерода (CO 2 ) с образованием карбоната калия (K 2 CO 3 ) и воды (H 2 O). Сколько граммов карбоната калия образуется, если 224,4 г КОН реагирует с 88,0 г СО 2 ? Реакция также дает 36,0 г воды.
Отвечать:
The Law is also applicable to both chemical and physical changes. For example, if you have an ice cube that melts into a liquid and you heat that liquid up, it becomes a gas. It will appear to have disappeared, but is still there.
Пример 3: Карбонат натрия реагирует с этановой кислотой с образованием этаноата натрия, диоксида углерода и воды. В эксперименте 5,3 г карбоната натрия реагировали с 6 г этановой кислоты с образованием 8,2 г этаноата натрия, 2,2 г диоксида углерода и 0,9 г воды. Покажите, что эти данные подтверждают закон сохранения массы.
Решение:
We know,
Sodium carbonate + ethanoic acid = sodium ethanoate + carbon dioxide + water.
Substituting the masses of the compounds we have,
5.3g + 6g = 8.2g + 2.2g + 0.9g • 11.3 g= 11.3g
Hence, the conservation of mass is verified.
Пример 4: Что происходит, когда 4,2 г KClO 3 нагревают с получением 1,92 г кислорода и 2,96 г KCl в качестве продукта? Как эта реакция соответствует закону сохранения массы?
Отвечать:
The reaction for the given case is given as,
KClO3 ⇢ KCl + 3/2 O2
Here, the total mass involved from the reactant side is equal to 4.2 g.
And the total mass involved from the product side is equal to 1.92 g + 2.96 g = 4.98 g.
Hence, the mass of the reactant < mass of the products involved in the reaction.
Thus, the given case doesn’t follow Law of Conservation of Mass.
Часто задаваемые вопросы о законе сохранения массы
Вопрос 1: Сформулируйте закон сохранения массы.
Отвечать:
According to the law of conservation of mass, mass is neither created nor destroyed during a chemical reaction. For example, when coal is burned, the carbon atom in it changes into carbon dioxide. The carbon atom changes from a solid to a gas, yet its mass remains constant.
Вопрос 2: Кто предложил закон сохранения массы?
Отвечать:
The Law of Conservation of Mass was invented in 1789 by a French chemist Antoine Lavoisier.
Вопрос 3: Почему химические реакции должны быть сбалансированы?
Отвечать:
Chemical reaction basically simulates a rearrangement of atoms. During the reaction, atoms (mass) can neither be created nor destroyed. In order to satisfy the chemical equations, equations must be balanced, since that states that matter cannot be produced or destroyed in a closed system.
Вопрос 4: Объясните, почему в ходе химической реакции масса не изменяется.
Отвечать:
Atoms can neither be created nor be destroyed during a chemical process. To create the products, the atoms of the reactants are only rearranged. Therefore, in a chemical reaction, there is no change in mass.
Вопрос 5: Испарение сохраняет закон сохранения массы. Объяснять.
Отвечать:
When we melt an ice cube, it turns into water. The weight of the ice cube and water is same. Therefore, the total mass remains preserved in case of a closed system.
Вопрос 6: Каковы некоторые реальные примеры закона сохранения массы?
Отвечать:
Some real-life examples of the law of conservation of mass are:
- Bonfire or Campfire – In a bonfire or a campfire the mass of the wood burned in the presence of air is equal to the mass of the ashes left, the carbon dioxide released, and water vapor obtained.
- Melted Ice – When a piece of ice is melted, then the liquid or water obtained through it weight equals.
Статьи по Теме
- Verification of Law of Conservation of Mass
- Law of Conservation of Momentum
- Law of Chemical Combination