Водородная связь
Водородная связь — это просто образование водородных связей. Водородная связь - это тип химической связи, которая обладает электростатической силой притяжения между атомом водорода и атомом, содержащим неподеленную пару электронов в химическом веществе. Водород должен быть присоединен к электроотрицательному атому, чтобы образовалась водородная связь. Следует отметить, что водородная связь не является ковалентной связью, однако присутствующие в ней атомы являются ковалентными.
Водородная связь возможна в тех случаях, когда молекула содержит сильно электроотрицательный атом, связанный с атомом водорода. Водородная связь в воде представляет собой прочную связь между ближайшей молекулой воды, содержащей один атом водорода, между двумя атомами кислорода. Водородная связь является основным из двух типов внутримолекулярной и межмолекулярной водородной связи на основе вовлеченных в нее атомов. Водородная связь максимальна в твердотельных соединениях.
Что такое водородная связь?
Hydrogen bonding is the formation of hydrogen bonds. Hydrogen bonds are the type of attractive intermolecular forces caused by the dipole-dipole interaction between a hydrogen atom bonded to a strongly electronegative atom of the same or another nearby electronegative atom.
Водород ковалентно связан с более электроотрицательным атомом кислорода в молекулах воды (H 2 O). В результате диполь-дипольных взаимодействий между атомом водорода одной молекулы воды и атомом кислорода другой молекулы Н 2 О в молекулах воды возникает водородная связь.
Связующая пара электронов в связи ОН в этом случае достаточно близка к ядру кислорода (из-за большой разницы электроотрицательностей кислорода и водорода). В результате атом водорода генерирует частичный положительный заряд (+), тогда как атом кислорода развивает частичный отрицательный заряд (-).
Электростатическое взаимодействие между атомом водорода одной молекулы воды (с зарядом +) и атомом кислорода другой молекулы воды (с зарядом -) теперь может вызывать образование водородных связей. В результате водородные связи представляют собой уникальный тип силы межмолекулярного притяжения, которая возникает только тогда, когда атомы водорода связаны с сильно электроотрицательным атомом. По сравнению с типичными диполь-дипольными и дисперсионными силами водородные связи в первую очередь прочны. Однако они слабее, чем настоящие ковалентные или ионные связи.
Важные условия образования водородных связей
- Атом, который связан с атомом водорода, имеет высокую электроотрицательность, что делает связь достаточно полярной. В молекуле должен присутствовать сильно электроотрицательный атом, связанный с атомом водорода. Степень поляризации молекулы увеличивается с увеличением электроотрицательности.
- Электроотрицательный атом, присоединенный к атому водорода, должен быть меньше по размеру. Чем больше электростатическое притяжение, тем меньше размер. Таким образом, меньший размер должен эффективно притягивать связывающую электронную пару.
Влияние водородных связей на элементы
- Диссоциация: HF диссоциирует в воде и выделяет дифторид-ион вместо фторид-иона. В HF это связано с водородной связью. Молекулы HCl, HBr и HI не образуют водородных связей. Это объясняет, почему не существует таких химических веществ, как KHCl 2 , KHBr 2 и KHI 2 .
- Ассоциация: из-за водородных связей молекулы карбоновых кислот существуют в виде димеров. Молекулярная масса таких соединений в два раза больше, чем рассчитанная по их простой формуле.
Примеры водородной связи
Вода
Отличным примером водородной связи является вода. Сильно электроотрицательный атом кислорода соединен с атомом водорода в молекуле воды. Общая пара электронов сильнее притягивается к атомам кислорода, и этот конец молекулы становится отрицательным, а атомы водорода — положительными.
Фторид водорода
Водородная связь сильнее среднего создается плавиковой кислотой и известна как симметричная водородная связь. Муравьиная кислота также может образовывать этот тип связи.
аммиак
Между водородом в одной молекуле и азотом в другой образуются водородные связи. Поскольку каждый атом азота имеет одну электронную пару, связь, возникающая в случае аммиака, относительно слаба. Метиламин также имеет эту форму водородной связи с азотом.
Спирт и карбоновая кислота
Тип химической молекулы с группой -ОН представляет собой спирт. В большинстве случаев водородная связь легко образуется, если любая молекула, содержащая атом водорода, немедленно соединяется либо с кислородом, либо с азотом.
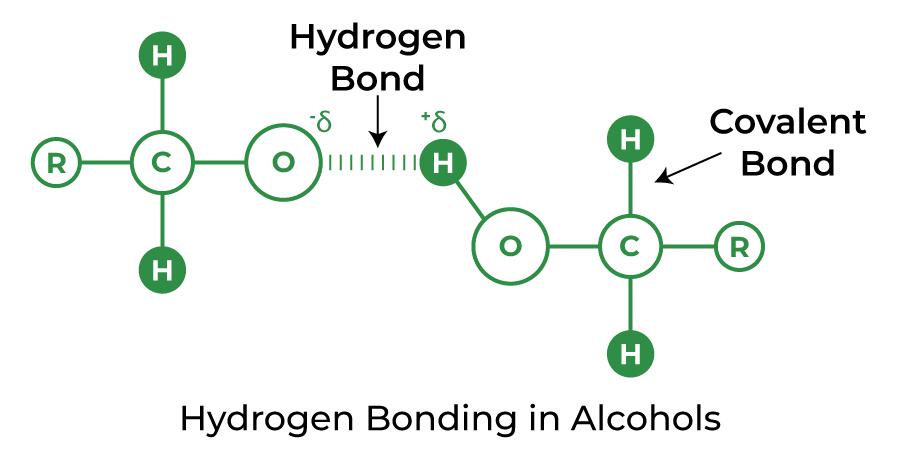
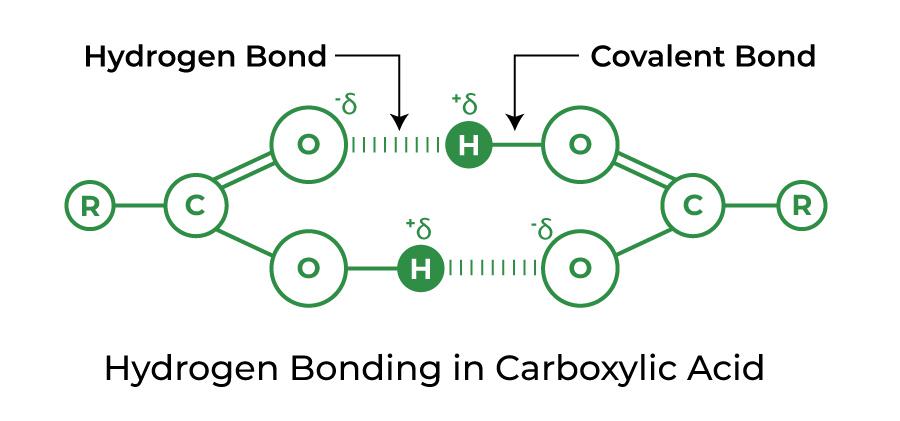
Strength of Hydrogen Bond: The hydrogen bond is a relatively weak one. Hydrogen bonds have a strength that is halfway between weak van der Waals forces and strong covalent bonds. The attraction of the shared pair of electrons, and hence the atom’s electronegativity, determines the hydrogen bond’s dissociation energy.
Свойства водородной связи
- Летучесть. Температура кипения соединений, содержащих водородные связи между отдельными молекулами, выше, поэтому они менее летучи.
- Растворимость. Из-за водородных связей, которые могут возникать между водой и молекулой спирта, низшие спирты растворимы в воде.
- Меньшая плотность льда, чем у воды . В случае твердого льда водородные связи заставляют молекулы воды образовывать клеточную структуру. На самом деле каждая молекула воды тетраэдрически связана с четырьмя другими молекулами воды. В твердом состоянии молекулы не так плотно упакованы, как в жидком состоянии. Эта похожая на футляр структура разрушается по мере таяния льда, сближая молекулы. В результате объем воды уменьшается, а плотность увеличивается при том же количестве воды. В результате при температуре 273 К лед имеет меньшую плотность, чем вода. Лед плавает из-за этого.
- Вязкость и поверхностное натяжение. Водородная связь встречается в соединениях, имеющих ассоциированную молекулу. В результате их течение усложняется. Они имеют высокое поверхностное натяжение и более высокую вязкость.
Why do hydrogen-bonded compounds have high melting and boiling points?
The melting and boiling temperatures of hydrogen-bonded compounds are unusually high. The elevated melting and boiling points of hydrogen-bonded compounds are attributable to the additional energy required to break these bonds.
- At room temperature, H2O is a liquid, whereas H2S, H2Se, and H2Te are all gases. Hydrogen bonding produces links in the water molecules, resulting in water having a higher boiling point than the other chemicals.
- Because there is hydrogen bonding in NH3, but not in PH3, ammonia has a higher boiling point than PH3.
- The presence of hydrogen bonding accounts for hydrogen fluoride’s particularly high boiling point among the halogen acids.
- Because ethanol contains hydrogen bonds, it has a higher boiling point than diethyl ether.
Типы водородной связи
Существует два типа Н-связей, которые обозначаются следующим образом:
Межмолекулярная водородная связь
Межмолекулярная водородная связь возникает, когда водородные связи образуются между молекулами одного и того же или разных веществ. Например, водородная связь в воде, спирте и аммиаке.
Внутримолекулярная водородная связь
Внутримолекулярная водородная связь относится к водородной связи, возникающей внутри одной молекулы. Это происходит в соединениях с двумя группами, одна из которых имеет атом водорода, связанный с электроотрицательным атомом, а другая имеет сильно электроотрицательный атом, связанный с менее электроотрицательным атомом другой группы. Связь создается между более электроотрицательными атомами одной группы и атомами водорода другой группы.
Часто задаваемые вопросы о водородной связи
Вопрос 1: Правило октета состояний.
Отвечать:
Atoms are most stable when their valence shells are filled with eight electrons, according to the octet rule. It is based on the observation that the atoms of the major group elements have a proclivity for chemical bonding in such a way that each atom in the resulting molecule has eight electrons in the valence shell. Only the core group elements are subject to the octet rule.
Вопрос 2: Какие факторы влияют на формирование ионной связи?
Отвечать:
Factors affecting the formation of Ionic Bond are:-
- Ionization Enthalpy
- Electron Gain Enthalpy
- Lattice Energy
Вопрос 3: Перечислите любые три характеристики ионных соединений.
Отвечать:
Characteristics of Ionic Compounds are as follows:-
- The melting and boiling points of ionic compounds are usually quite high. This is due to the strong electrostatic forces that hold ions together in ionic compounds.
- Ionic compounds are frequently found in solid form.
- Ionic compound solutions are excellent electrical conductors. In their molten condition, they are also good conductors of electricity.
Вопрос 4: Что такое водородная связь?
Отвечать:
When a hydrogen atom is coupled to a highly electronegative atom, the shared pair of electrons are attracted more by this atom, and the molecules’ negative end becomes slightly negative while the positive end becomes slightly positive.The negative end of one molecule attracts the positive end of the other, resulting in the formation of a weak bond. This connection is referred to as Hydrogen Bonding.
Вопрос 5: Какие условия необходимы для водородной связи?
Отвечать:
Conditions required for Hydrogen Bonding are:
- A highly electronegative atom must be coupled to the hydrogen atom in the molecule. The polarisation of a molecule is proportional to its electronegativity.
- The electronegative atom should be modest in size. The greater the electrostatic attraction, the smaller the size.