Серная кислота – H2SO4
Серная кислота или серная кислота представляет собой минеральную кислоту, состоящую из одного атома серы, четырех атомов кислорода и двух атомов водорода. Химическая или молекулярная формула серной кислоты – H 2 SO 4 . Серная кислота является одним из наиболее важных химических веществ, используемых в коммерческих целях. Он также известен как маттлинговая кислота, сульфат водорода или купорос. Серная кислота является очень сильной кислотой и вязкой жидкостью. Это бесцветная, маслянистая жидкость без запаха, едкая по своей природе. Серная кислота является компонентом кислотных дождей, поскольку она растворима в воде.
Серная кислота является очень кислой жидкостью. В результате он используется для очистки металлов, извлечения примесей из нефти, производства химических веществ, таких как азотная кислота и соляная кислота, а также производства красителей, лекарств, моющих средств и взрывчатых веществ, среди других процессов. Молярная масса серной кислоты составляет 98,079 г/моль. Плотность Серной кислоты составляет 1,83 г/см 3 . Молекула H 2 SO 4 ковалентна и имеет тетраэдрическое строение и моноклинную кристаллическую структуру.
Что такое серная кислота?
Sulfuric acid is a highly reactive chemical. Sulfuric acid is used in many industries like lead-based automobile batteries, the production of various chemicals, glue, and explosives, the refinement of petroleum, the curing of metal, etc. Hence, due to these wide applications, it is referred to as the “King of Chemicals“. The chemical formula for Sulfuric or Sulphuric Acid is H2SO4.
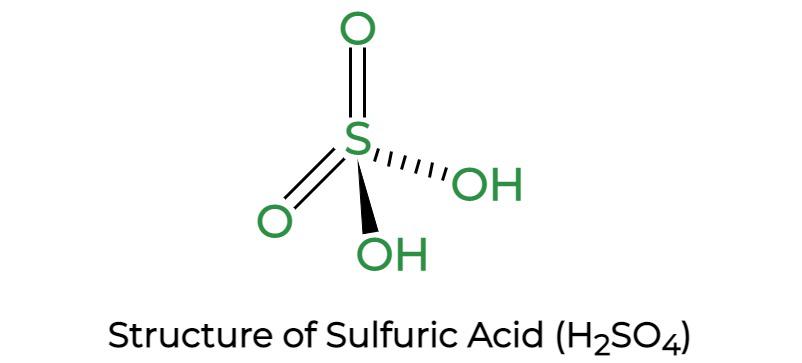
Как показано ниже, серная кислота (H 2 SO 4 ) представляет собой ковалентное соединение, состоящее из атома серы, который присоединен к двум атомам кислорода и двум молекулам гидроксила (-ОН).
Свойства серной кислоты (H 2 SO 4 )
Физические свойства серной кислоты
- H 2 SO 4 — вязкая, густая, бесцветная, маслянистая жидкость.
- Серная кислота имеет плотность 1,84 г/мл, температуру кипения 337 °С и температуру плавления 10 °С.
- Концентрированная серная кислота на 98% состоит из воды и является наиболее стабильной формой. Многие другие концентрации с разными названиями доступны для различных целей, например, аккумуляторная кислота с концентрацией 29–32 %, камерная кислота с концентрацией 62–70 % и башенная кислота с концентрацией 78–80 %.
- Он имеет удельный вес 1,84 при 298 К.
- Синяя лакмусовая полоска окрашивается в красный цвет, а значения pH серной кислоты в ммоль/л указаны в таблице ниже,
| значения рН | 1 мМ | 10 мМ | 100 мМ |
| Серная кислота (в ммоль/л) | 2,75 | 1,87 | 1.01 |
- Он очень едкий, что делает его опасным для прикосновения.
Химические свойства серной кислоты
- H 2 SO 4 — сильная кислота, которая в водном растворе полностью диссоциирует на ионы в виде,
H2SO4 ⇢ H2+ + SO4-2
- Серная кислота является хорошим окислителем, так как она окисляет другие вещества, отдавая свои атомы кислорода в химической реакции. Как показано ниже, он окисляет углерод и серу.
2H2SO4 + C ⇢ 2H2O + 2SO2 + CO2
2H2SO4 + S ⇢ 2H2O + 3SO2
- Серная кислота энергично реагирует с водой в сильно экзотермической реакции (т. е. с выделением тепла).
- Серная кислота является двухосновной кислотой и выделяет два иона водорода на молекулу.
- Серная кислота обладает гигроскопическими свойствами, что означает, что H 2 SO 4 может поглощать и контролировать влажность окружающей среды. Этот эффект делает его хорошим обезвоживающим средством.
- Он менее летучий. Вот почему он способствует получению более летучих кислот из их комплементарных солей.
Структура серной кислоты
Два атома кислорода образуют двойные связи с атомом серы, а две гидроксильные группы (ОН) образуют одинарные связи с атомом серы. Из-за своей способности высвобождать два протона это дипротонная кислота. Как показано ниже, молекула имеет тетраэдрическую структуру и является ковалентной.
Приготовление серной кислоты
Серную кислоту обычно получают и производят следующими двумя широко используемыми способами.
- Контактный процесс
- Процесс ведущей палаты
Контактный процесс производства серной кислоты
The Contact Process comprises three phases in the production of sulphuric acid:
- Preparation ofSulphur dioxide by burning sulphur or sulphide ores in the air.
S (s) + O2 (g) → SO2 (g)
- Reaction between sulphur dioxide with oxygen in the presence of V2O5 catalyst to produce Sulphur trioxide (SO3) as,
2SO2 (g) + O2 (g) → 2SO3 (g)
- Conversion of Sulphur Trioxide into Sulphuric Acid as,
SO3 + H2SO4 (Oleum) → H2S2O7
H2S2O7 (l) + H2O (l) → 2H2SO4 (Sulfuric Acid)
The sulphuric acid obtained by the Contact process is 96–98% pure.
Процесс ведущей палаты
One of the most popular manufacturing processes is the lead Chamber method. It produces around 50 to 60 B-grade acids. Wet SO2 in the presence of nitrogenous oxides is used in this procedure (dynamic impetus). As a result, it undergoes oxidation with airborne oxygen to produce sulphur trioxide. This reaction is stated as,
2SO2 + O2 → 2SO3
Then, water and sulphur trioxide are allowed to interact, resulting in H2SO4. This reaction is stated as,
SO3 + H2O → H2SO4
Молекулярная масса серной кислоты
Серная кислота имеет химическую формулу H 2 SO 4 . Согласно этой формуле, одна молекула серной кислоты (H 2 SO 4 ) содержит 2 моля водорода, 1 моль серы и 4 моля атомов кислорода. В результате молекулярная масса H 2 SO 4 будет равна сумме масс двух молей водорода, одного моля серы и четырех молей кислорода. Поскольку атомная масса водорода равна 1u, атомная масса серы равна 32u, а атомная масса кислорода равна 16u, молекулярную массу серной кислоты можно рассчитать следующим образом:
The molecular mass of H2SO4 = Mass of 2 moles of hydrogen atoms + Mass of 1 mole of sulphur + Mass of 4 moles of oxygen atoms
= 2 × 1 + 32 + 4 × 16
= 2 + 32 + 64
= 98 u
Thus, the molecular mass of sulphuric acid is 98u and the molecular weight of sulphuric acid is 98 g/mol.
Реакции серной кислоты
- Dissociation- When pure water-free sulphuric acid is cooked, sulfur trioxide and water are formed.
H2SO4 → SO3 + H2O
- Acidic Character of Sulphuric Acid- It’s a common dibasic acid that turns blue litmus crimson when exposed to it. It divides into two groups of salts.
NaOH + H2SO4 → NaHSO4 + H2O
2NaOH + H2SO4 → Na2SO4 + 2H2O
- Sulphonating Action of Sulphuric Acid- Concentrated sulphuric acid combines with a variety of organic molecules, such as benzene, toluene, and others, to form sulphonic acids, as an example.
C6H6 + H2SO4 → C6H5SO3H + H2O
- Precipitation Reactions with Sulphuric Acid- It creates insoluble sulfates that precipitate when handled with aqueous solutions of barium, lead, and other salts, for example.
H2SO4 + BaCl2 → BaSO4↓ + 2HCl
- Reaction with Sulphur Trioxide- Oleum, commonly known as fuming sulphuric acid, is formed when it dissolves sulfur trioxide.
H2SO4 + SO3 → H2S2O7
Использование серной кислоты
Серная кислота известна как один из наиболее важных реагентов и имеет несколько промышленных применений. Несколько экземпляров включают:
- Таким способом изготавливают такие удобрения, как сульфат аммония, суперфосфат извести и другие.
- В производстве красок, взрывчатых веществ и фармацевтических препаратов.
- H 2 SO 4 используется в производстве кислот, таких как HCl и HNO 3 .
- Например, в производстве пигментов, красок и полимеров.
- Например, в бумажной и текстильной промышленности.
- Нитроцеллюлоза используется в производстве товаров.
- Применение в металлургии (пример: очистка металлов перед эмалированием, гальванопокрытием и цинкованием).
- В кожевенном деле.
- В отсеках для хранения.
- В нефтегазовом секторе.
- В сфере моющих средств.
- Работает как дегидратор.
- В качестве реагента в лаборатории.
Часто задаваемые вопросы о серной кислоте
Вопрос 1: Каково использование серной кислоты?
Отвечать:
Fertilizers, dyestuffs, explosives, and pharmaceuticals are all made with sulphuric acid. It is also used to make acids such as HCl and HNO3. It’s frequently utilised in the metallurgical industry (Example: Cleaning metals before enamelling, electroplating and galvanising).
Вопрос 2: Почему серную кислоту называют королем химических веществ?
Отвечать:
Sulphuric acid, sometimes known as the “king of chemicals,” is one of the most significant substances. It’s also known as vitriol oil since it used to be made from green vitriol back in the day. It is very corrosive and more reactive than other acids. As a result, it has a wide range of uses, including usage in laboratories, batteries, detergents, and the manufacture of numerous medications.
Вопрос 3. Что произойдет при взаимодействии серной кислоты с водными растворами солей бария?
Отвечать:
It generates insoluble sulphates that precipitate when handled with aqueous solutions of barium salts.
H2SO4 + BaCl2 → BaSO4↓ + 2HCl
Вопрос 4: Что произойдет, если серная кислота прореагирует с трехокисью серы?
Отвечать:
Sulphuric acid dissolves sulphur trioxide to generate oleum, often known as fuming sulphuric acid.
H2SO4 + SO3 → H2S2O7
Вопрос 5: Какова структура серной кислоты?
Отвечать:
In sulphuric acid, two hydrogen atoms are firmly bonded to two oxygen atoms, resulting in two-OH groups. The molecule is covalent and has a tetrahedral structure.
Вопрос 6: Какая кислота самая сильная в мире?
Отвечать:
Fluoroantimonic acid is a superacid mixture of Antimony Pentafluoride and Hydrofluoric Acid, which is the strongest in the world.
Статьи по Теме
- Acids, Bases, and Salts
- Types of Acids
- Sulfurous Acid Formula