Перекись водорода — использование, свойства, приготовление, примеры
Химический элемент водород имеет символ H и атомный номер 1. Самый легкий элемент — водород. В нормальных условиях водород представляет собой газ, состоящий из двухатомных молекул с формулой H 2 . Он не имеет запаха, бесцветен, нетоксичен и чрезвычайно легко воспламеняется. Водород — самый распространенный химический элемент во Вселенной, на его долю приходится около 75% всех обычных веществ. Солнце, например, в основном состоит из водорода в плазменном состоянии. Большая часть водорода на планете находится в форме молекул, таких как вода и органические вещества. Каждый атом наиболее распространенного изотопа водорода (символ 1H) имеет один протон, один электрон и ни одного нейтрона.
Открытие перекиси водорода
Простейшим представителем семейства перекисей является перекись водорода, которая первоначально была открыта как химическое вещество в 1818 году французским химиком Ж. Л. Тенаром. H 2 O 2 – его молекулярная формула. Перекись водорода содержится в очень малых количествах в окружающей среде. Фотохимические реакции в атмосфере вокруг Земли приводят к образованию газообразной перекиси водорода. Он используется как дезинфицирующее средство, а также как отбеливающее средство. Он кислый, с pH от 6 до 7 при 298 градусах по Фаренгейту.
Структура перекиси водорода
- Ион пероксида ( O 2–2 ) присутствует в пероксиде, химической молекуле. (O–O) 2– представляет собой пероксидный ион, который состоит из одиночной связи между двумя атомами кислорода. Это мощный окислитель.
- Перекись водорода представляет собой неплоскую молекулу, состоящую из двух атомов кислорода, соединенных одной ковалентной связью, известной как пероксидная связь.
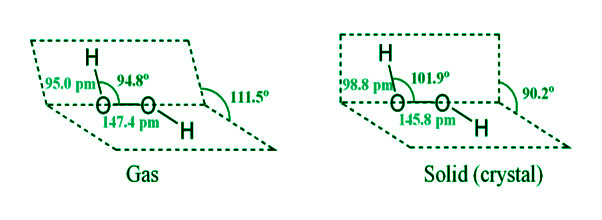
- Она оформлена как книга. Каждый атом кислорода также соединен с атомом водорода одним звеном. Поскольку неподеленные пары электронов отталкивают друг друга на атомах кислорода, две связи не лежат в одной плоскости. Когда пероксид водорода находится в газообразном состоянии, двугранный (межплоскостной) угол между двумя плоскостями составляет 111,5 o , а когда он кристаллический, он равен 90,2 o . Этому способствует внутримолекулярная водородная связь.
Параметры водородной связи в газовой и кристаллической фазах:
Использование перекиси водорода
Перекись водорода — это жидкость, которую можно использовать по-разному. Он работает во всех средах, включая воду, воздух, сточные воды и почвы. Для улучшения и ускорения процессов его иногда комбинируют с другими агентами. Ниже приведены некоторые из его применений:
- На отбеливание целлюлозы и бумаги расходуется около половины мирового производства перекиси водорода.
- Человеческие волосы отбеливают разбавленной перекисью водорода в сочетании с водным раствором аммиака.
- Новые пятна крови удаляются перекисью водорода.
- Раствор H 2 O 2 используется в качестве топлива для торпед и подводных лодок, а также в качестве окислителя для ракетного топлива.
- В аквакультуре перекись водорода используется для снижения смертности, вызванной различными микроорганизмами.
- Его можно использовать для стерилизации косметических кистей и дезинфекции зубных щеток.
- Перекись водорода — это мягкий антисептик, который можно использовать для небольших порезов, царапин и ожогов, чтобы предотвратить инфекцию.
- Его также можно использовать в качестве жидкости для полоскания рта, чтобы удалить слизь и облегчить незначительный дискомфорт во рту.
- Помогает в лечении грибковых инфекций растений и очистке водоемов от водорослей.
- Он используется в текстильной промышленности в качестве антихлора для устранения избытка хлора после отбеливания.
- Он широко используется в производстве неорганических химикатов, таких как перборат натрия и перкарбонат, которые являются важными компонентами высококачественных моющих средств.
- Применяется для восстановления цвета свинцовых картин, потемневших в результате воздействия H 2 S воздуха на свинцовые краски.
Свойства перекиси водорода
Ниже приведены физические и химические свойства перекиси водорода:
Физические свойства перекиси водорода
- В безводном состоянии перекись водорода имеет бледно-голубой цвет. Из-за связи Н– представляет собой густую сиропообразную жидкость без запаха.
- Он имеет горький вкус, который вызывает волдыри на коже.
- Он растворим в воде, спирте и эфире.
- Перекись водорода более вязкая и плотная (1,44 г/см 3 ), чем вода. Это связано с тем, что молекулы H 2 O 2 имеют более прочные связи H–, чем молекулы H 2 O.
- Он имеет температуру кипения 150 градусов по Цельсию и температуру замерзания -0,89 градусов по Цельсию. Температура кипения перекиси водорода повышается еще выше, потому что межмолекулярные водородные связи прочнее, чем у воды.
- Перекись водорода имеет немного более высокий дипольный момент (2,1D), чем вода (1,84D).
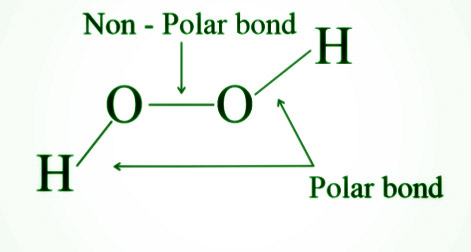
- Перекись водорода имеет как полярные, так и неполярные связи и является диамагнитной.
Химические свойства перекиси водорода
Благодаря своей молекулярной структуре H 2 O 2 является уникальным в своем роде материалом. Он состоит из атомов кислорода в степени окисления -1, в отличие от степени окисления 0 или -2 во многих других соединениях. Это указывает на то, что в зависимости от pH раствора это химическое вещество может действовать как окислитель, так и восстановитель.
- Разложение
- Разложение под действием света: Воздействие света также разлагает H 2 O 2 . В результате его хранят в покрытых воском стеклянных или пластиковых сосудах со стабилизаторами, такими как мочевина.
- Самоокисление и самовосстановление. Перекись водорода в чистом виде представляет собой очень нестабильную жидкость. При длительном хранении или нагревании он разлагается на воду и кислород.
Присутствие металлов, таких как платина, золото, оксиды металлов (MnO 2 ) или специфических ионов металлов, таких как ионы Fe 2+ , ускоряет процесс разрушения. Его разрушению способствует даже шероховатая поверхность.
- Кислотная природа
- H 2 O 2 является слабой кислотой, так как окрашивает лакмус в красный цвет. На лакмус не влияет его водный раствор. H 2 O 2 лишь незначительно сильнее, чем H 2 O, потому что его константа диссоциации (1,55×10 –12 при 293 К) немного выше, чем у H 2 O (1,0×10 –14 ).
- Реакции нейтрализации перекиси водорода с гидроксидами и карбонатами демонстрируют ее кислотный характер. Например , Ba(OH) 2 +H 2 O 2 →BaO 2 +2H 2 O
- Поскольку H 2 O 2 состоит из двух ионизируемых атомов H, она образует два типа солей: гидропероксиды (кислые соли) и пероксиды (пероксиды) (нормальные соли).
- Уменьшение собственности-
Перекись водорода действует как восстановитель как в кислых, так и в щелочных средах при наличии сильных окислителей. Комбинация H 2 O 2 и образующегося кислорода [O], генерируемого сильным окислителем, приводит к образованию молекулярного кислорода во всех этих процессах.
H 2 O 2 + [O] (из окислителя) → H 2 O + O 2
- In acidic medium: Hydrogen peroxide loses electrons and is oxidized to O2 in an acidic environment.
H2O2(O.S=–1)→2H++O2(O.S=0)+2e–[Oxidation]
For example,
1) H2O2 turns a pink acidified potassium permanganate solution into a colorless solution.
2KMnO4+3H2SO4+5H2O2→K2SO4+2MnSO4+8H2O+5O2
2) In the presence of dilute sulphuric acid, it converts manganese dioxide to manganese sulphate.
MnO2(aq)+2H+(aq)+H2O2→Mn2+(aq)+2H2O(l)+O2(g)
- In alkaline medium: Hydrogen peroxide is converted to O2 in an alkaline media.
H2O2+2OH–→2H2O+O2+2e
For example,
1) Ferric salts are converted to ferrous salts.
2Fe3+(aq)+H2O2(aq)+2OH–(aq)→2Fe2+(aq)+O2(g)+2H2O(l)
2) In the basic media, it converts iodine to iodide ions.
I2(s)+H2O2(aq)+2OH–(aq)→2I–(aq)+2H2O(l)+O2(g)
- Окисляющее свойство-
H 2 O 2 является сильным окислителем, потому что она легко принимает электроны и восстанавливается как в щелочной, так и в кислой среде.
- In an acidic medium: In the presence of an acidic media, H2O2 can receive electrons and behave as an oxidising agent. H2O2 is decomposed into H2O.
H2O2+2H++2e–→2H2O( Eo=+1.77V)
For example,
1) Acidified ferrous sulphate is converted to ferric sulphate.
2Fe2+(aq)+H2O2(aq)+2H+(aq)→2Fe3+(aq)+2H2O(l)
2) It extracts iodine from a potassium iodide solution that has been acidified.
2I–(aq)+H2O2(aq)+2H+(aq)→I2(s)+2H2O(l)
- In an alkaline medium: In an alkaline media, hydrogen peroxide can take electrons and operate as an oxidising agent.
H2O2+OH–+2e–→3OH–
For example,
1) When hydrogen peroxide oxidises manganese salts to manganese dioxide, a brownish precipitate results.
Mn2+(aq)+H2O2(aq)+2OH–(aq)→MnO2(s)+2H2O(l)
2) When chromium sulphate is oxidized by hydrogen peroxide in an alkaline media, the dark green colour changes to yellow sodium chromate.
Cr2(SO4)3+3H2O2+10NaOH→2Na2CrO4+3Na2SO4+8H2O
- In neutral medium: In a neutral media, hydrogen peroxide oxidises a wide range of substances. For example,
1) It oxidizes sulphites to sulphates.
SO2–3+H2O2→SO2–4+H2O
2) It converts nitrites to nitrates by oxidising them.
NO–2+H2O2→NO–3+H2O
Приготовление перекиси водорода
Лабораторная подготовка
- Из перекиси натрия (процесс Мерка): перекись натрия вводят небольшими количествами в слабый раствор серной кислоты (20%), окруженный льдом, и при этой процедуре постоянно перемешивают. При дальнейшем охлаждении раствора выпадают кристаллы Na 2 SO 4 . 10H 2 O, которую можно отфильтровать. Раствор представляет собой 30-процентный водный раствор перекиси водорода.
Na 2 O 2 +H 2 SO 4 →Na 2 SO 4 +H 2 O 2
- Из пероксида бария: пасту из гидратированного пероксида бария (BaO 2 .8H 2 O), приготовленную в ледяной воде, обрабатывают 20%-ным ледяным раствором серной кислоты. Фильтрование используется для удаления осадка BaSO 4 белого цвета. Около 5% H 2 O 2 остается в растворе.
BaO 2 ⋅ 8H 2 O+H 2 SO 4 →BaSO 4 (белый ppt)+H 2 O 2 +8H 2 O
Этот метод неэффективен, поскольку сульфат бария образует защитную оболочку вокруг H 2 O 2 , которая препятствует продолжению химической реакции. Ионы Ba 2+ в растворе медленно разлагают перекись водорода. В результате раствор не может храниться в течение длительного периода времени. Для проверки этого используется фосфорная кислота, а не серная кислота. Образующийся фосфат бария полностью выпадает в осадок, и в отсутствие ионов Ba 2+ нет угрозы распада перекиси водорода.
3BaO 2 ⋅8H 2 O+2H 3 PO 4 →Ba 3 (PO 4 ) 2 (ppt)+24H 2 O+3H 2 O 2
Промышленная подготовка
- Путем электролиза раствора серной кислоты: В ячейке электролизуется 50 % раствор серной кислоты. На аноде образуется пероксодисерная кислота, в результате чего на катоде выделяется водород.
H 2 SO 4 →HSO – 4 +H +
На аноде: HSO – 4 → H 2 S 2 O 8 (перекись серной кислоты) +2e –
На катоде: 2H + +2e – →H 2
Перекись серной кислоты из клетки удаляется и разлагается водой с образованием перекиси водорода.
H 2 S 2 O 8 +2H 2 O→2H 2 SO 4 +H 2 O 2
Серная кислота с высокой температурой кипения не перегоняется, в отличие от перекиси водорода. При электролизе смеси сульфата аммония и серной кислоты в равных пропорциях выход перекиси водорода можно увеличить.
Пероксид водорода получают путем перегонки сульфата пероксида аммония, образующегося на аноде, с водой.
(NH 4 )2S 2 O 8 +2H 2 O→2NH 4 HSO 4 (гидрогенсульфат аммония)+H 2 O 2
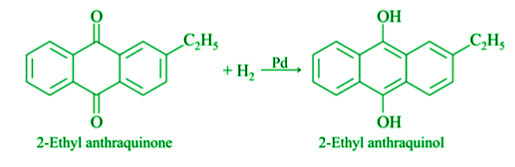
- Из 2-этилантрахинона: Газообразный водород пропускают через растворенный в бензоле 2-этилантрахинон в присутствии палладиевого катализатора. Он расщепляется на 2-этил антрахинол. Затем в воздухе циркулирует смесь 2-этилантрахинола, бензола и циклогексанола. Перекись водорода образуется, когда она снова окисляется до 2-этилантрахинона.
- Путем окисления изопропилового спирта: когда небольшое количество перекиси водорода смешивается с изопропиловым спиртом, он действует как инициатор. При температуре около 340 К и при небольшом давлении через раствор проходит кислород. В результате реакции окисления образуются ацетон и перекись водорода.
CH 3 CHOHCH 3 (изопропиловый спирт)+O 2 →CH 3 RED 3 (ацетон)+H 2 O 2
Примеры вопросов
Вопрос 1: Безопасно ли использовать перекись водорода?
Отвечать:
Most people are safe when they utilise hydrogen peroxide correctly. However, if a person takes the substance too frequently or in a high dosage, it might be dangerous. To avoid irritation, it’s critical to use a concentration of no more than 3% and to use it sparingly. Because there is a risk of swallowing hydrogen peroxide, children should avoid handling it.
Вопрос 2: Убивает ли перекись водорода микробы?
Отвечать:
When hydrogen peroxide is allowed to stay on surfaces for at least 10 minutes at room temperature, it is most effective. Hydrogen peroxide can deactivate a wide range of microorganisms, including viruses, bacteria, fungus, and spores, and acts as a disinfectant by eliminating critical components of germ cells.
Hydrogen peroxide is a good option to use on inanimate surfaces like metal, glass, and plastics when it comes to reducing germs in your home and containing the spread of Covid19. According to the Centers for Disease Control and Prevention (CDC) (CDC).
Вопрос 3: Перекись водорода сильнее отбеливателя?
Отвечать:
When we talk about bleach, we’re talking about chlorine bleach, which is made up of sodium hypochlorite. Bleach, like hydrogen peroxide, produces nascent oxygen, which is a bleaching agent. Despite the fact that bleach is more powerful than hydrogen peroxide, it is a very dangerous toxin. It requires careful dilution for safe use, and only cold water should be used. Hydrogen peroxide, on the other hand, has a lower environmental impact and is effective in treating wastewater and disinfecting substances.
Вопрос 4: Отбелит ли полоскание перекисью зубы?
Отвечать:
Gargling with hydrogen peroxide may help to relieve a sore throat, disinfect the mouth, and whiten the teeth. However, it should be diluted. If swallowed, a higher concentration of hydrogen peroxide causes internal organ damage as well as excessive bleeding. While rinsing with the diluted solution, prevent ingestion. To develop whiter teeth with merely gargling or rinsing, though, you’ll need to do it for a long time.
Вопрос 5: Что такое процесс Merck?
Отвечать:
In this technique, sodium peroxide is added in minute amounts to a weak sulphuric acid (20%) solution covered by ice and regularly stirred. Crystals of Na2SO4. 10H2O occur as the solution is cooled further, and they can be filtered out. A 30 percent hydrogen peroxide aqueous solution is used.
Na2O2+H2SO4→Na2SO4+H2O2
Вопрос 6: В чем разница между водой и перекисью водорода?
Отвечать:
Water and hydrogen peroxide have different physical properties according to the extent of hydrogen bonding. Peroxide has a higher hydrogen bonding strength than water because it has one more oxygen atom than water, allowing for greater hydrogen bonding.
Because of the strain in the O–O bond in hydrogen peroxide, the chemical characteristics of water and hydrogen peroxide differ. The lone pairs on two oxygen atoms in hydrogen peroxide cause a lot of strain, weakening the O–O bond and allowing it to breakdown quickly into water and oxygen. With the exception of the water molecule, this is not the case. It doesn’t have any O–O bond tension.