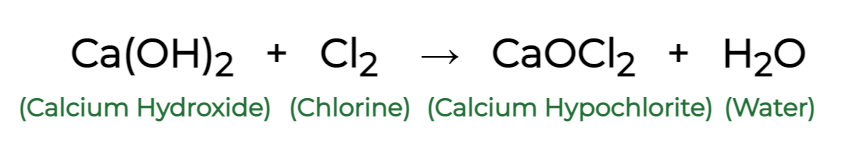Хлор (Cl)
Хлор — это химический элемент, который обозначается символом Cl . Хлор присутствует в 17-й группе (группа галогенов) и 3-м периоде периодической таблицы. Хлор является вторым по легкости галогеном, который находится между фтором и бромом в группе галогенов. Хлор представляет собой желто-зеленый газ с резким запахом при комнатной температуре с атомным номером 17 и атомной массой 35,45. Хлор используется в качестве дезинфицирующего средства для очистки плавательных бассейнов и т. д., но это токсичный, коррозионный газ, который может раздражать глаза и дыхательную систему при прямом контакте. Давайте узнаем больше об элементе хлор в этой статье.
Что такое хлор?
Chlorine takes on the appearance of pale yellow-green gas. Chlorine in liquid form can burn the skin, and chlorine in gaseous form irritates the mucous membrane.
В периодической таблице он находится между фтором и бромом. Он имеет электронную конфигурацию [Ne] 3s 2 3p 5 . Стабильные изотопы хлора — один и два. Хлорид натрия является наиболее распространенным химическим веществом хлора, а хлористый водород является наиболее основным. Хлорид натрия имеет молекулярную формулу NaCl, а хлористый водород имеет молекулярную формулу HCl. Обладает высокой реакционной способностью. Хлор был открыт в 1774 году шведским ученым Карлом Вильгельмом Шееле.
Структура хлора
Хлор имеет атомный номер 17. Это означает, что атомная структура хлора имеет в общей сложности 17 протонов и 17 электронов. Эти электроны организованы в три электронные оболочки: K, L и M. У хлора есть два электрона на первой электронной оболочке и восемь электронов на второй электронной оболочке. Наконец, самая внешняя электронная оболочка атома хлора (также известная как валентная оболочка) имеет в общей сложности 7 электронов.
В результате валентность хлора часто принимается равной 7. Однако стоит отметить, что хлору требуется всего один дополнительный электрон, чтобы завершить свою октетную структуру. В результате валентность хлора также можно считать равной 1.
Из приведенного выше рисунка видно, что электронная конфигурация хлора [Ne] 1s 2 2s 2 2p 6 3s 2 3p 5 , поскольку хлор имеет 17 электронов в нем и 7 электронов в его валентной оболочке.
Электронно-точечная структура хлора
Физические и химические свойства хлора
- Хлор представляет собой газ и имеет зеленовато-желтый цвет при комнатной температуре и атмосферном давлении.
- Хлор является вторым галогенным элементом группы 17 (группа галогенов) p-элементов с
- Атомный номер (Z) или молярная масса хлора: 17
- Атомная масса хлора: 35,45
- Температура кипения хлора: 239,11 К
- Температура плавления хлора: 171,6 К.
- Плотность хлора: 1,5625 г/см 3
- Электроотрицательность хлора: 3,16.
- Валентность хлора: 1
- Химическая формула или символ хлора: Cl
- Хлор в 2,5 раза тяжелее воздуха.
- Хлор является сильно электроотрицательным и сродным к электрону элементом.
- При наличии древесного угля реакция между хлором и водородом происходит быстро в темноте.
- Из-за своего сильного сродства к водороду хлор может реагировать с широким спектром молекул. Например, когда хлор соединяется с углеводородами, атомы хлора постепенно замещают атомы водорода. Однако атомы хлора легко присоединяются к двойной или тройной связи, если углеводород ненасыщен.
- Каждая молекула хлора содержит два атома (Cl 2 ). За исключением более легких благородных газов, практически все элементы взаимодействуют с хлором с образованием хлоридов.
- Хлориды большинства металлов представляют собой ионные кристаллы, но хлориды полуметаллов и неметаллов представляют собой преимущественно молекулы.
Изотопы хлора
Элемент хлор (Cl) имеет в общей сложности 25 изотопов в диапазоне от 28 Cl до 52 Cl. Из этих 25 изотопов только два изотопа стабильны. Стабильные изотопы хлора - это 35 Cl с содержанием 75,77% и 37 Cl с содержанием 24,23%, что дает хлору стандартный атомный вес 35,45. Дольше всех прожил радиоактивный изотоп 36 Cl, период полураспада которого составляет 3,01 × 10 5 лет.
Использование хлора
- Используется для устранения запаха гниения.
- Он используется в качестве дезинфицирующего средства.
- Для уничтожения микроорганизмов при обработке питьевой воды используется хлор.
- Применяется при очистке бассейнов.
- Он используется в производстве бумаги и изделий из бумаги.
- Используется как антисептик.
- Его используют в производстве лекарств.
- Он используется в производстве красок и полимеров.
Часто задаваемые вопросы о хлоре
Вопрос 1: Хлор – это металл или неметалл?
Отвечать:
Yes, Chlorine is a metal, it is a yellowish-green gas with a high degree of reactivity. Chlorine reacts with various metals to form a wide range of compounds.
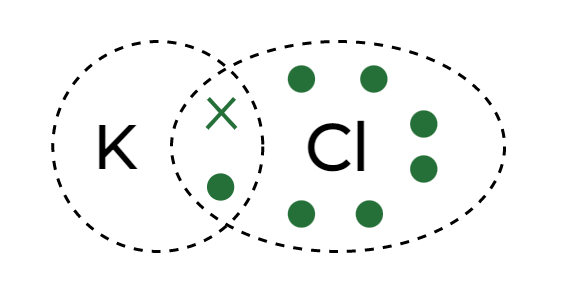
Вопрос 2: Напишите структуру электронных точек для хлорида калия.
Отвечать:
Since, the number of valence electrons in Potassium (K) and Chlorine (Cl) are 1 and 7, respectively.
Hence, the electron dot structure for Potassium Chloride is below:
Вопрос 3: Что происходит, когда известковая вода реагирует с хлором?
Отвечать:
Lime water reacts with chlorine to give Calcium hypochlorite (CaOCl2) or Bleaching Powder as shown in the chemical reaction below:
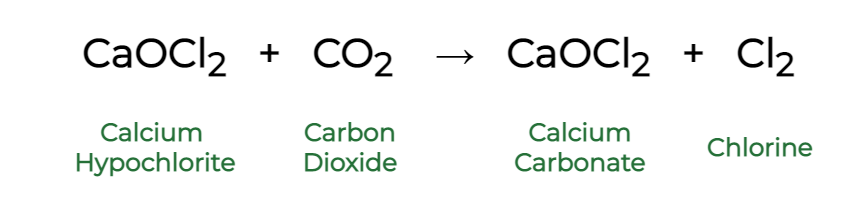
Вопрос 4: Почему отбеливающий порошок дает запах хлора?
Отвечать:
Bleaching powder gives the smell of chlorine because it reacts with the Carbon dioxide present in nature to give Calcium carbonate and Chlorine, as shown in the reaction below:
Вопрос 5: Почему газообразный хлор зеленый?
Отвечать:
Chlorine is a yellow-green gas at room temperature. Chlorine has a strong, unpleasant, bleach-like odour that can be perceived even at low concentrations. Because the chlorine gas concentration is approximately 2.5 times that of air, it will initially remain close to the ground in locations with low air movement.
Вопрос 6: Является ли хлор ядовитым газом?
Отвечать:
Gaseous chlorine is toxic and is classified as a lung irritant. It has an intermediate water solubility and the ability to produce acute harm to the upper and lower respiratory tracts. Chlorine gas is immediately detectable due to its strong odour.
Вопрос 7: Что такое хлорирование?
Отвечать:
Chlorination is a typical chemical treatment used to destroy bacteria in water.
Вопрос 8: Какова валентность хлора?
Отвечать:
In its atomic structure, chlorine has 17 protons and 17 electrons. These electrons are organised into three basic electron shells. The first electron shell has two electrons, whereas the second electron shell has eight electrons. Finally, there are 7 electrons in the valence shell. As a result, the valency of chlorine is frequently assumed to be 7.
Статьи по Теме
- Chlorine gas Formula
- Chlorine Family
- Sulfuric Acid