Формула сульфата хрома III – структура, свойства, применение, примеры вопросов
Хром (Cr), химический элемент 6-й группы (VIb) Периодической таблицы, используется в сплавах для повышения прочности и коррозионной стойкости - серый металл. Хром используется при закалке стали, производстве нержавеющей стали (названа потому, что не ржавеет) и производстве различных сплавов. Хромирование может использоваться для придания стали полированной поверхности.
Сульфат представляет собой оксоанион серы, полученный депротонированием обеих ОН-групп серной кислоты. Он играет роль человеческого метаболита, метаболита Saccharomyces cerevisiae и кофактора. Это оксоанион серы, оксид серы, неорганический анион и двухвалентный неорганический анион.
Сульфат хрома (III) Хром (сульфат III) — неорганическое соединение с соотношением хрома к сульфату 2:3. Формула сульфата хрома (III) — Cr 2 (SO 4 ) 3 . Это также сине-серое твердое вещество, которое растворяется в воде. При нагревании он меняет цвет с синего на зеленый. Давайте узнаем формулу сульфата хрома (III) здесь.
Сульфат хрома (III) обычно представляет собой неорганическое соединение формулы Cr 2 (SO 4 ) 3 .x(H 2 O). x находится в диапазоне от 0 до 18. Кроме того, хорошо известен неопределенный, но коммерчески важный «основной сульфат хрома». Эти соли обычно имеют фиолетовое или зеленое твердое вещество, которое растворяется при помещении в воду. Его часто используют для дубления кожаных материалов.
Структура сульфата хрома (II)
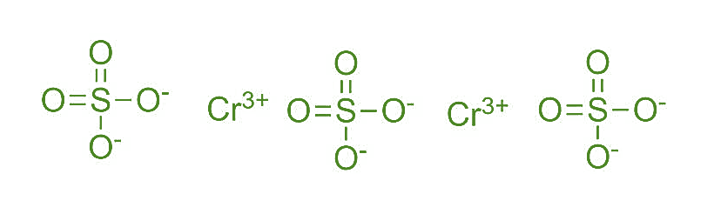
Производство сульфата хрома (III)
- Сульфат хрома (III) образуется как побочный продукт процесса окисления Джонса. В этом процессе раствор дихромата натрия или бихромата калия растворяют в серной кислоте для окисления спирта.
3C2H5OH + 2 K2Cr2O7 + 8H2SO4 ⇢ 2Cr(SO4)3 + 3CH3COOH + 2H2SO4 + 11H2O
- Сульфат хрома (III) также можно получить обработкой гидроксида хрома (III) разбавленной серной кислотой.
Cr(OH)2 + H2SO4 ⇢ CrSO4 + 2H2O
- Сульфат хрома (III) образуется в результате реакции двойного замещения между хлоридом хрома и серной кислотой.
2CrCl3 + 3H2SO4 ⇢ Cr2(SO4)3 + 6HCl
Физические свойства сульфата хрома (III)
- Молярная масса - 392,16 г/моль (безводный)
- Это сине-серое твердое вещество
- Химическая формула Cr 2 (SO 4 ) 3
- Температура плавления – 90 °С
- Температура кипения – выше 700 °C.
- Плотность -3,1 г/см³ (безводный)
Химические свойства сульфата хрома (III)
- Когда сульфат хрома (III) реагирует с фосфатом цезия, он дает фосфат хрома и сульфат цезия, что представляет собой реакцию двойного замещения.
Cr2(SO4)3 + 2Cs3PO4 ⇢ 2CrPO4 + 3Cs2SO4
- При взаимодействии сульфата калия с сульфатом хрома (III) образуются хромо-калиевые квасцы.
K2SO4 + Cr2(SO4)3 + 24H2O ⇢ 2KCr(SO4)2 . 12H2O ⇣
Использование
- Используется как электролит для получения металлического хрома.
- Используется для хромирования других металлов в декоративных и защитных целях.
- Используется в качестве протравы для дубленой кожи.
- Придает зеленый цвет лакам, краскам, керамической глазури и чернилам.
Примеры вопросов
Вопрос 1: Как происходит окисление Cr в Cr 2 (SO 4 ) 3 ?
Отвечать:
Now consider that the oxidation number of Cr is x.
Since Cr2(SO4)3 is a molecule, its oxidation number is 0.
This is the normal oxidation number of (SO4) = -2.
Therefore, mathematically,
2 x + 3 (-2) = 0
2x = +6
x = +3
Cr2(SO4)3 has an oxidation number of Cr of +3.
Вопрос 2: Каким соединением является сульфат хрома (III)? Он ионный или молекулярный?
Отвечать:
Chromium(III) Sulfate Cr2(SO4)3 is an ionic compound, Cr is a metal with a Cr+3 cation, and sulfate is a SO4-2 anion. Sulfur and oxygen atoms are in parentheses, indicating covalent bonds between them. Cr has no square brackets, indicating that it is not a polyatomic ion.
Вопрос 3: Почему сульфат хрома III становится зеленым при нагревании?
Отвечать:
Chromium (III) complexes generally exhibit slow ligand exchange. When the aqueous Answer of this compound is heated, the color turns green as a result of the slow dissociation of the water ligand and the coordination of the sulfate ions.
Вопрос 4: Рассчитайте количество сульфат-ионов в 39,2 г сульфата хрома.
Отвечать:
Gram molecular mass of Cr2(SO4)3 = 392.6 g
No. of moles in 30 g of Cr2(SO4)3 = 30/392.6 = 0.07 mol
1 mol of Cr2(SO4)3 contains = 3 x 6.023 x 1023 sulfate ions
So, No. of Sulfate ions in 0.07 mol of Cr2(SO4)3 will be= 0.07 x 3 x 6.023 x 1023
= 1.2648 x 1023.
Вопрос 5: Как определить формулу сульфата хрома (III)?
Отвечать:
To determine the formula for chromium (III) sulfate, we use a criss-cross method that exchanges the charges carried by the cations and anions present in the ionic compound. Chromium III has a valence of 3 and sulfate has a valence of 2. Two chromium ions and three sulfate ions are required to balance the six valence bonds. Therefore, the charge carried by the chromium cation Cr+3 is written as an index of the sulfate anion SO4-2, and the charge carried by the sulfate anion SO4-2 is written as an index of the chromium cation Cr + 3. The polyatomic ion SO4-2 is enclosed in parentheses. Therefore, to obtain the formula for chromium (III) sulfate, exchange the charges of ions Cr+3 and SO4-2 to obtain Cr2 and (SO4)3. If you write these two together, you will get Cr2(SO4)3.
Вопрос 6: Какая польза от сульфата хрома?
Отвечать:
The uses of chromium sulfate are as follows:
- Widely used in the leather industry in the tanning process.
- Used for dyeing textile dyes, especially khaki fabrics.
- Also used in green paints, ceramic glazes, and inks.
- Used in chrome plating to decorate and protect the metal.
Вопрос 7: Растворяется ли сульфат хрома III в воде?
Отвечать:
Chromium sulfate (III) usually refers to an inorganic compound of formula Cr2(SO4)3. x(H2O), where the range of x is 0-18. In addition, “basic chromium sulfate”, which is not clearly defined but is commercially important, is known. These salts are usually purple or green solids that are soluble in water.