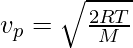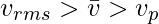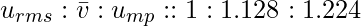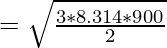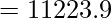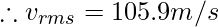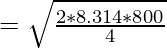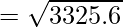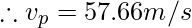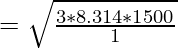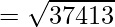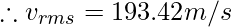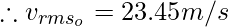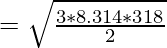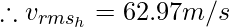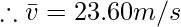Формула молекулярной скорости
Молекулярная скорость определяется как скорость группы молекул в идеальном газе. Молекулярная скорость является важным понятием в кинетической теории газов. Согласно кинетической теории газов, молекулы газа находятся в постоянном движении и движутся прямолинейно, пока не столкнутся с другой молекулой. Все молекулы идеального газа испытывают упругое столкновение. Это объясняет, почему маленькие молекулы диффундируют быстрее, чем большие. Молекулярная скорость газа прямо пропорциональна его скорости и обратно пропорциональна его молярной массе. Молекулярная скорость газа увеличивается с повышением температуры газа. Например, гелий имеет наименьшую молекулярную массу и, следовательно, самую высокую молекулярную скорость.
Типы молекулярной скорости
Концепция молекулярной скорости гласит, что группа атомов движется с типичной скоростью. Частицы идеального газа не соприкасаются друг с другом. Давайте посмотрим на различные типы молекулярной скорости и способы их расчета. Молекулярная скорость может быть трех типов:
Средняя молекулярная скорость
Это средняя скорость группы молекул в газе. Он обозначается с помощью 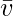 . Его можно рассчитать по формуле:
. Его можно рассчитать по формуле:
where,
- T is the temperature of the gas in Kelvin
- M is the molar mass
- R is the Ideal gas constant, 8.314 kg*m2/s2*mol*K
Среднеквадратичная скорость
Это мера скорости частиц в конкретном газе. Он обозначается v rms и может быть рассчитан по формуле:
where,
- T is the temperature of the gas in Kelvin
- M is the molar mass
- R is the Ideal gas constant, 8.314 kg*m2/s2*mol*K
Наиболее вероятная скорость
Это скорость, которую приобретает большинство молекул газа. Он обозначается v p и может быть рассчитан по следующей формуле:
where,
- T is the temperature of the gas in Kelvin
- M is the molar mass
- R is the Ideal gas constant, 8.314 kg*m2/s2*mol*K
Связь между молекулярными скоростями
Объем молекулы газа мал по отношению ко всему объему сосуда, когда речь идет о молекулярных скоростях частицы. Частицы газа перемещаются свободно и с полной подвижностью. Следовательно, сила притяжения между молекулами газа отсутствует.
- Соотношение между средней молекулярной скоростью, среднеквадратичной скоростью и наиболее вероятной скоростью:
- Соотношение между средней молекулярной скоростью, среднеквадратичной скоростью и наиболее вероятной скоростью составляет:
Максвелловское распределение молекулярных скоростей
Максвелл и Больцман вывели уравнение для нахождения распределения различных типов молекулярных скоростей в газе. Количество молекул на единицу скорости указано на оси ординат графика распределения Максвелла-Больцмана. Количество молекул в газе представлено общей площадью под всей кривой. Пик графика сдвинется вправо, если нагреть газ до большей температуры (поскольку средняя молекулярная скорость увеличится). График становится выше и уже по мере того, как газ становится холоднее, подобно тому, как график укорачивается и расширяется по мере того, как газ нагревается.
Выводы из графика
- Наиболее вероятная скорость представлена пиком кривой. Средняя молекулярная скорость — это скорость, которая чуть выше наиболее вероятной скорости. Среднеквадратичная скорость совпадает со средней кинетической энергией молекул газа.
- Кривая будет расширяться и сглаживаться, когда мы наблюдаем газ при повышении температуры.
- Форма кривой зависит от молярной массы и температуры газа.
- Кривая становится более высокой и плоской, когда мы рассматриваем газы с увеличивающейся молекулярной массой.
- С повышением температуры наиболее вероятная скорость увеличивается, а пик кривой смещается вправо. Частицы газа также стремятся двигаться быстрее.
Решенные примеры на молекулярной скорости
Пример 1: Температура газа с молекулярной массой 2 г/моль составляет 900К. Вычислите среднеквадратичную скорость частиц газа.
Решение:
Given, M = 2g/mol, T = 900K
R = 8.314
Пример 2: Рассчитайте наиболее вероятную скорость газообразного гелия при температуре 800К.
Решение:
Given, T = 800K
For Helium, M = 4g/mol and R = 8.314
Пример 3: Определить скорость частиц m = 1 г/моль и температуру 1500 К.
Решение:
Given, M = 1g/mol, T = 1500K and R = 8.314
Пример 4: Сравните следующие величины: среднеквадратичную скорость кислорода при 80 °C и среднеквадратичную скорость водорода при 45 °C.
Решение:
To compare the quantities, we shall calculate the rms for oxygen and hydrogen for the given conditions.
Oxygen:
Given T = 80
C = 353K, Molar mass of oxygen (M) = 16g/mol
Hydrogen:
Given, T = 45°, C = 318K, Molar mass of Hydrogen (M) = 2g/mol
Thus, rms velocity of hydrogen is more than Oxygen at the given conditions.
Пример 5: Найти среднюю молекулярную скорость газа с молекулярной массой 19 г при 500К.
Решение:
Given, T = 500K, M = 19g/mol
Часто задаваемые вопросы о молекулярной скорости
Вопрос 1. Что понимается под кинетической теорией газов?
Решение:
Based on the notion that a gas is made up of atoms or molecules that are moving quickly, kinetic theory describes how gases behave.
Вопрос 2: Почему более мелкие атомы газа движутся быстрее?
Решение:
Because of the molecular mobility of molecules, smaller gas particles travel more quickly. At all temperatures higher than absolute zero, they have kinetic energy. The average kinetic energy of gas molecules and temperature are directly inversely correlated. At the same temperature and pressure, lighter gases will also move at speeds that are higher than heavier gases.
Вопрос 3: Что понимается под степенью свободы?
Решение:
The amount of independent ways that the system’s path and configuration might vary is referred to as the degree of freedom.
Вопрос 4: Опишите среднюю энергию.
Решение:
The mean energy or internal energy of one mole of gas is called the mean energy. It is represented by the letter U.