Формула ацетата аммония - структура, свойства, использование, примеры вопросов
Ацетат аммония представляет собой химическое соединение в виде белого кристаллического вещества с легким уксусным запахом. Атом водорода в уксусной кислоте заменен ионом аммония. Чаще всего используется в качестве регулятора кислотности пищевых продуктов, также используется в процессах диализа и используется в качестве реагента в сельскохозяйственных продуктах, и он не вреден при меньшем воздействии. При сильном воздействии ацетата аммония это вызовет раздражение всего тела. Ацетат аммония состоит из атомов углерода, азота, водорода и кислорода. Один атом углерода связан с 3 атомами водорода, а другой атом углерода связан с 2 атомами кислорода, один с двойной связью и один с одинарной связью. Атом кислорода, связанный одинарной связью, снова связанный с азотом, имеет 4 атома водорода. Ацетат аммония также называют духом миндереруса.
ацетат аммония
Ацетат аммония представляет собой химическое соединение, содержащее слабую кислоту и слабое основание, поэтому его можно использовать в качестве буферного агента вместе с уксусной кислотой. Ацетат аммония содержит 2 атома углерода, 7 атомов водорода, 1 атом азота и 2 атома кислорода. Атом водорода в уксусной кислоте заменен ионом аммония. Наконец, это дает ацетат аммония. И это предшественник ацетамида, который используется в качестве мочегонного средства. При дальнейшем нагревании он превращается в ацетонитрил (метилцианид).
Формула ацетата аммония
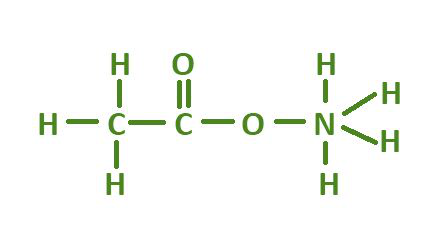
Химическая формула ацетата аммония C 2 H 7 NO 2 . Другие названия: спирт Миндереруса, этаноат аммония, ацетат азания.
Структура ацетата аммония
Ацетат аммония содержит 2 атома углерода, 7 атомов водорода, 1 атом азота и 2 атома кислорода. Химическая формула ацетата аммония C 2 H 7 NO 2 . В уксусной кислоте один атом водорода заменен ионом аммония. Название IUPAC ацетата аммония - этаноат аммония.
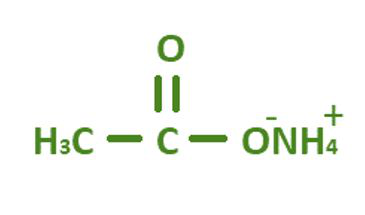
Физические свойства ацетата аммония
- Ацетат аммония представляет собой кристаллическое белое твердое вещество (расплывающееся) со слабым уксусным запахом.
- Плотность ацетата аммония составляет 1,17 г/см 3 при 20°С.
- Температура плавления ацетата аммония составляет 113°C (или) 235°F.
- Растворимость ацетата аммония в воде составляет 102 г/100 мл при 0°С.
- Молярная масса ацетата аммония составляет 77,083 г/моль.
Химические свойства ацетата аммония
- Ацетат аммония является предшественником ацетамида и используется как мочегонное средство. При дальнейшем нагревании ацетамид превращается в ацетонитрил (метилцианид).
- Обычно ацетат аммония используется только при получении или синтезе ацетамида.
NH4CH3CO2 ⇢ CH3C(O)NH2 + H2O
Приготовление ацетата аммония
- Ацетат аммония получают реакцией ледяной уксусной кислоты с аммиаком.
CH3COOH + NH3 ⇢ CH3COONH4
- Ацетат аммония получают нейтрализацией уксусной кислоты карбонатом аммония.
2CH3COOH + [NH4]2CO3 ⇢ 2CH3COONH4 + H2CO3
H2CO3 ⇢ CO2 + H2O
Использование ацетата аммония
- Ацетат аммония используется в качестве регулятора кислотности пищевых продуктов.
- Ацетат аммония используется в сельскохозяйственной продукции.
- Ацетат аммония используется в качестве реагента в процессах диализа для устранения загрязняющих веществ.
- Ацетат аммония используется для консервирования пищевых продуктов.
- Ацетат аммония используется в качестве реагента для определения емкости почвенного катионного обмена.
- Ацетат аммония используется в производстве поролона.
- Ацетат аммония используется в качестве катализатора в процедуре конденсации Кнёвенагеля.
- Ацетат аммония используется для приготовления буферных растворов.
- Ацетат аммония используется в производстве виниловых пластиков.
Примеры вопросов
Вопрос 1: Опасен ли ацетат аммония?
Отвечать:
In general Ammonium acetate is not dangerous, but in some cases, higher exposure or inhalation of Ammonium acetate may causes irritation in the mouth and nose as highly as respiratory tract irritation. Swallowing may causes stomach irritation If the skin is highly exposed to Ammonium acetate it causes skin irritation and eyes irritation.
Вопрос 2: Как ацетат аммония используется в качестве буферного агента?
Отвечать:
Ammonium acetate is a mixture of both weak acid and weak base, so we can make a buffer solution by using this Ammonium acetate along with acetic acid to control the pH.
Вопрос 3: Какой индикатор используется в растворе ацетата аммония?
Отвечать:
The Ammonium Acetate buffer in water is used, If Formic acid is used to adjust the pH used for separation should be pH 3.8 to 5.8. If Ammonia is used to adjust the pH used for separation should be pH 8.5 to 10.5
Вопрос 4: Что происходит при нагревании ацетата аммония?
Отвечать:
The Ammonium acetate decomposes at higher temperatures (Above 165°C) and forms Acetamide when heating, On further heating the Acetamide converts into Acetonitrale also called methyl cyanide.
Вопрос 5: Каковы другие названия ацетата аммония?
Отвечать:
Other names of Ammonium acetate are,
- Spirit of Mindererus,
- Ammonium ethanoate,
- Azanium acetate.
Вопрос 6: Каково использование ацетата аммония в эксперименте?
Отвечать:
Commonly Ammonium Acetate is used as Buffer, Ammonium acetate is a combination of a weak acid and weak base, commonly used in the preparation of buffer solutions along with Acetic acid. Ammonium acetate is used to replace the cell buffers that contain the nonvolatile salts in the preparation of samples for spectroscopy or mass spectroscopy.
Вопрос 7: Как следует хранить ацетат аммония?
Отвечать:
The Ammonium acetate can be stored in a well-closed container with a tight lid, stored in a cool and dry place, and kept in a well-ventilated area. Store in a protected area from moisture and keep away from incompatible substances. Ammonium acetate may burn in critical conditions. Use Dry chemicals, water spray, or foam as extinguishers. The nitrogen oxides and ammonia release poisonous gases.