Физические и химические свойства эфиров
Органические химические вещества, такие как спирт, фенол и эфир, широко используются как в бытовых, так и в промышленных условиях. Духи, дезинфицирующие средства и топливо — все это примеры этих товаров, которые по-разному используются в нашей повседневной жизни.
Что такое эфиры?
Эфиры представляют собой форму органической молекулы, в которой один атом кислорода соединяет две углеводородные группы (алкильные или арильные). Он представлен с помощью формулы ROR'.
В формуле R' углеводородная группа может быть такой же или отличной от R.
Эфиры образуются при замене атома водорода гидроксильной группы в спиртах на алкильную или арильную группу.
Например-
Кислород и углерод в связи COC находятся в состоянии sp 3 гибридизации. Отталкивание двух неподеленных пар (lp) на атоме кислорода вызывает искривленную форму. Наличие объемных групп на обоих концах атома кислорода, а также отталкивание bp-bp, приводящее к валентному углу COC около 111,7, создают стерический барьер.
Классификация эфиров
Эфиры делятся на два типа в зависимости от групп в R и R':
- Простые эфиры или симметричные эфиры: эти эфиры имеют одну и ту же алкильную группу на обоих концах атома кислорода. Например,
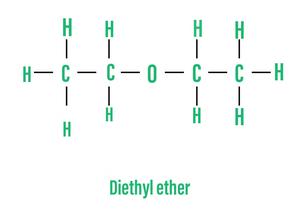
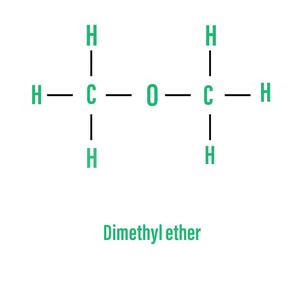
- Смешанные эфиры или асимметричные эфиры: эти эфиры состоят из разных алкильных групп на обоих концах атома кислорода. Например,
Этилметиловый эфир
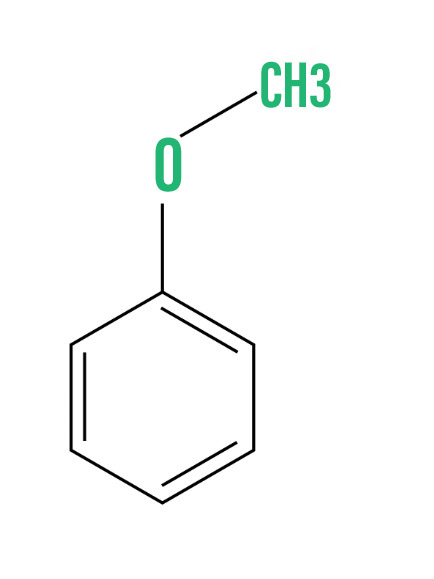
Метилфениловый эфир
Физические свойства эфиров
Физические характеристики эфиров следующие:
- Физическое состояние: другие ингредиенты представляют собой летучие жидкости без запаха, тогда как метоксиметан и метоксиэтан представляют собой газы. К низшим гомологам относятся бесцветные, приятно пахнущие летучие жидкости с характерным запахом эфира.
- Полярная природа эфира. Эфиры имеют полярный характер. Причиной этого является разница в электроотрицательности между атомами кислорода и углерода. Атом кислорода подталкивает общую пару электронов ближе к себе из-за разницы в электроотрицательности, что приводит к частичному отрицательному заряду на атоме кислорода и частичному положительному заряду на атоме углерода. Две полярные связи С—О в эфире наклонены друг к другу под углом 111,7°. В результате два диполя не компенсируются, что приводит к чистому дипольному моменту. т. е. в эфире дипольный момент (μ) ≠ 0. Эфиры более полярны, чем алкены, но не так полярны, как спирты, сложные эфиры или амиды со сходной структурой.
- Водородная связь эфира: атом водорода не связан напрямую с атомом кислорода в эфирах. В результате эфиры не содержат водородных связей между молекулами. С другой стороны, простые эфиры используются только для принятия водородных связей. Водородная связь с молекулами воды возможна, потому что атомы кислорода имеют две неподеленные пары электронов.
По сравнению с линейными алифатическими эфирами циклические эфиры, такие как тетрагидрофуран и 1,4-диоксан, смешиваются с водой из-за более открытого атома кислорода для водородной связи.
- Температура кипения эфира: Поскольку эфиры не образуют внутримолекулярных водородных связей, их температура кипения ниже, чем у изомерных спиртов, но ближе к температуре кипения алканов той же массы. Хотя оба вещества имеют одинаковую химическую формулу C 2 H 6 O, температура кипения метоксиметана (CH 3 OCH 3 ) ниже, чем у этанола (CH 3 CH 2 OH).
- Растворимость эфира: эфиры, содержащие до трех атомов углерода, смешиваются с водой. Это связано с тем, что меньшие эфиры легче образуют водородные связи с молекулами воды. Эфиры состоят из двух типов молекул: неполярной гидрофобной углеводородной цепи и полярного гидрофильного кислородного конца. Растворимость эфира в воде уменьшается по мере увеличения размера алкильной группы. Это связано с неполярной природой углеводородного компонента, который препятствует образованию водородных связей с полярными молекулами воды. Органические растворители, такие как спирты, бензол и ацетон, относительно растворимы в эфирах. Диэтиловый эфир и н-бутиловый спирт, например, растворимы в воде в одинаковой степени. Потому что эфир образует водородную связь с водой так же, как и спирт.
- Кислотность: вода, эфиры и спирты имеют одинаковые кислородные связи. Поскольку кислород более электроотрицателен, чем углерод, альфа-альфа атомов водорода в эфирах простых углеводородов более кислая. Они гораздо менее кислые, чем альфа-карбонильные группы водорода (например, в кетонах или альдегидах).
- Эфиры легче воды.
Химические свойства эфиров
- Эфиры — бесцветные, приятно пахнущие, чрезвычайно летучие и горючие жидкости. Эфиры плохо растворимы в воде из-за Н-связей и гидрофобных алкильных или арильных групп.
- Внутри себя эфиры не имеют водородных связей. В результате их температуры кипения значительно ниже, чем температуры кипения эквивалентных спиртов.
- Пары диэтилового эфира используются в качестве анестетика, поскольку при вдыхании они вызывают потерю сознания.
- Поскольку эфиры имеют валентный угол C-O-C около 110 ∘ , дипольные моменты двух связей C-O не компенсируются. В результате эфиры полярны, но их полярность слабая (для диэтилового эфира =1,18D).
- Реакционная способность простых эфиров ниже, чем у сложных функциональных групп. На них не действуют активные металлы, сильные основания, восстановители и окислители. Наличие алкильной группы, неподеленной пары электронов у атома кислорода и разрыв связи С-О придают простым эфирам их химические характеристики.
Реакции, связанные с алкильной группой
- Горение: Эфиры чрезвычайно горючи, и когда они вступают в контакт с воздухом, они образуют углекислый газ и воду.
С 2 Н 5 ОС 2 Н 5 + 6О 2 → 4СО 2 + 5Н 2 О
- Галогенирование: алкильная группа эфира подвергается процессу замещения хлором или бромом в отсутствие солнечного света, в результате чего получаются а-галогенированные эфиры.
Все атомы водорода в эфирах замещаются в присутствии солнечного света.
Реакция на эфирный кислород
- Образование перекиси: когда эфир вступает в контакт с атмосферным кислородом в присутствии солнечного света, он взаимодействует с кислородом с образованием перекиси эфира из-за присутствия неподеленной пары электронов в эфирном кислороде. При нагревании перекись эфира очень нестабильна и сильно взрывается, вызывая серьезные аварии. В результате кипячение пробы эфира, выдержанной длительное время, опасно.
- Образование солей оксония: поскольку простые эфиры могут действовать как слабые основания Льюиса, они могут образовывать соли оксония при растворении в холодных сильных минеральных кислотах, таких как соляная или серная кислота.
Реакции в ароматических эфирах
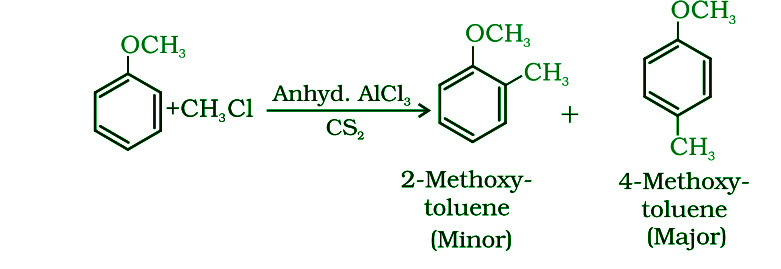
- Галогенирование: в бензольном кольце фенилалкиловые эфиры подвергаются нормальному галогенированию. Даже в отсутствие катализатора бромида железа (III) анизол проводит бромирование бромом в этановой кислоте. Метоксигруппа активирует бензольное кольцо, что приводит к этой реакции. Пара-изомер получается в качестве основного продукта в 90% случаев.
- Реакция Фриделя-Крафтса: Процесс Фриделя-Крафтса включает добавление алкильных и ацильных групп в орто- и пара-положениях в анизоле посредством реакций с алкилгалогенидом и ацилгалогенидом в присутствии безводного хлорида алюминия (кислота Льюиса) в качестве катализатора.
- Нитрование: Орто- и пара-нитроанизолы образуются при взаимодействии анизола с сильными серной и азотной кислотами.
Использование эфиров
- Эфир является растворителем для растворения масла, смолы, бензина, смолы и других материалов.
- Благодаря своей практически инертной природе и высокой растворяющей способности они также используются в качестве реакционных сред для ряда процедур, таких как синтез реактива Гриньяра, реакция Вюрца и т.д.
- Он также служит местным анестетиком.
- Он также используется для поддержания прохладной окружающей среды.
Примеры вопросов
Вопрос 1: Какова классификация эфира?
Отвечать:
Ethers are divided into two categories based on the presence of a hydrocarbon (aryl or alkyl) chain at both ends of the oxygen atom: simple or symmetrical ethers, and mixed or asymmetrical ethers.
- Simple or symmetrical ethers are created when the hydrocarbon (aryl or alkyl) chain present at both ends of the oxygen atom is the same. CH3OCH3 is an example.
- Mixed or asymmetrical ethers are created when the hydrocarbon (aryl or alkyl) chain present at both ends of the oxygen atom is different. -CH3OC2H5 is an example.
Вопрос 2: Почему эфиры растворимы в воде?
Отвечать:
Two alkyl groups (R–O–R′) are connected to the ends of an oxygen atom in ethers. Because of its high electronegativity, oxygen behaves as a hydrogen-bond acceptor and is soluble in water in the same way that alcohols are.
Вопрос 3: Как превратить спирт в эфир?
Отвечать:
The production of ethers is caused by the acid catalysed dehydration of primary alcohols. A condensation reaction occurs when two molecules of primary alcohol combine to generate a bigger one while also freeing a tiny molecule of water.
Вопрос 4: Почему эфир хранят в бутылке с железной проволокой?
Отвечать:
When exposed to sunlight, ether reacts strongly with ambient oxygen, creating peroxide, which explodes when heated, resulting in a major accident.
When ether is held in a bottle with iron wire, oxygen reacts with the iron to generate iron oxide, which prevents ether from becoming peroxide. As a result, ether is stored in a container with iron wire inside.
Вопрос 5: Для чего используется диэтиловый эфир?
Отвечать:
- Oils, fats, gums, resins, polymers, and other similar compounds are mostly dissolved in it.
- It performs the function of a refrigerant.
- It is used as a general anaesthetic in surgery.
- Under the brand name Natalite, it is combined with alcohol and used as a fuel alternative.
Вопрос 6: Каковы физические свойства эфиров?
Отвечать:
- In an ether molecule, there is a net dipole moment. This is due to the polarity of the C−O bond.
- Ether has a boiling point similar to that of alkanes.
- Ether is miscible with water in the same way as alcohol is.
- In water, ether molecules are miscible.
Вопрос 7: Что такое реакция Фриделя-Крафтса?
Отвечать:
The Friedel-Crafts procedure involves reacting an alkyl halide and an acyl halide in the presence of anhydrous aluminium chloride (a Lewis acid) to add alkyl and acyl groups at ortho and para positions in anisole.